Kategorijos: Teminiai straipsniai » Pradedantieji elektrikai
Peržiūrų skaičius: 52646
Straipsnio komentarai: 4
Tranzistoriai 2 dalis. Laidininkai, izoliatoriai ir puslaidininkiai
Straipsnio pradžia: Tranzistoriaus istorija, Tranzistoriai: paskirtis, įtaisas ir veikimo principai
 Elektrotechnikoje naudojamos įvairios medžiagos. Medžiagų elektrines savybes lemia elektronų skaičius išorinėje valentinėje orbitoje. Kuo mažiau elektronų yra šioje orbitoje, tuo silpnesni jie yra susieti su branduoliu, tuo lengviau jie gali keliauti.
Elektrotechnikoje naudojamos įvairios medžiagos. Medžiagų elektrines savybes lemia elektronų skaičius išorinėje valentinėje orbitoje. Kuo mažiau elektronų yra šioje orbitoje, tuo silpnesni jie yra susieti su branduoliu, tuo lengviau jie gali keliauti.
Temperatūros svyravimų įtakoje elektronai atitrūksta nuo atomo ir juda interatominėje erdvėje. Tokie elektronai vadinami laisvaisiais, o jie laidininkuose sukuria elektros srovę. Ar yra daug tarptominių erdvių, ar yra laisvų elektronų, galinčių judėti materijos viduje?
Kietų medžiagų ir skysčių struktūra atrodo ištisinė ir tanki, primenanti sriegio rutulio struktūrą. Tačiau iš tikrųjų net kietosios dalelės labiau primena žvejybos ar tinklinio tinklą. Žinoma, to negalima pastebėti namų ūkio lygmeniu, tačiau tiksliais moksliniais tyrimais nustatyta, kad atstumai tarp elektronų ir atomų branduolio yra daug didesni nei jų pačių matmenys.
Jei atominio branduolio dydis rutulio pavidalu vaizduojamas kaip futbolo rutulio dydis, tada šiame modelyje elektronai bus žirnio dydžio, ir kiekviena tokia žirnelė yra nuo „šerdies“ kelių šimtų ir net tūkstančių metrų atstumu. O tarp branduolio ir elektrono yra tuštuma - paprasčiausiai nieko nėra! Jei įsivaizduosime atstumus tarp materijos atomų toje pačioje skalėje, matmenys iš viso pasirodys fantastiški - dešimtys ir šimtai kilometrų!
Geri elektros laidininkai yra metalai. Pavyzdžiui, aukso ir sidabro atomai išorinėje orbitoje turi tik vieną elektroną, todėl jie yra geriausi laidininkai. Geležis taip pat veda elektrą, bet šiek tiek prasčiau.
Elektrą laidokite dar blogiau didelio atsparumo lydiniai. Tai yra nichromo, manganino, konstanto, fechralio ir kiti. Tokia didelio atsparumo lydinių įvairovė lemia tai, kad jie skirti išspręsti įvairias problemas: kaitinimo elementus, deformacijų matuoklius, pamatinius varžus matavimo priemonėms ir dar daugiau.
Norint įvertinti medžiagos sugebėjimą praleisti elektrą, reikia apibūdinti: "Elektros laidumas". Grąžinimo vertė yra atsparumas. Mechanikoje šios sąvokos atitinka specifinį sunkumą.
Izoliatoriaiskirtingai nuo laidininkų, nėra linkę prarasti elektronų. Juose elektronų ryšys su branduoliu yra labai stiprus, o laisvųjų elektronų beveik nėra. Tiksliau, bet labai nedaug. Tuo pačiu metu kai kuriuose izoliatoriuose jų yra daugiau, todėl jų izoliacijos kokybė yra prastesnė. Pakanka palyginti, pavyzdžiui, keramiką ir popierių. Todėl izoliatorius sąlygiškai galima suskirstyti į gerus ir blogus.
Net izoliatoriuose laisvieji krūviai atsiranda dėl šiluminių elektronų virpesių: esant aukštai temperatūrai blogėja izoliacinės savybės, kai kurie elektronai vis tiek sugeba atitrūkti nuo branduolio.
Taip pat idealaus laidininko varža būtų lygi nuliui. Bet laimei tokio laidininko nėra: įsivaizduokite, kaip Ohmo dėsnis ((I = U / R)) būtų rodomas nulyje vardiklyje !!! Atsisveikinimas su matematika ir elektrotechnika.
Ir tik esant absoliučiai nulinei temperatūrai (-273,2 ° C) šiluminiai svyravimai visiškai sustoja, o blogiausias izoliatorius tampa pakankamai geras. Norint skaitmeniniu būdu išsiaiškinti, ar tai „blogai“, reikia naudoti pasipriešinimo sąvoką. Tai yra kubo, kurio kraštinės ilgis yra 1 cm, atsparumas omomis, o varžos matmuo gaunamas omu / cm. Specifinis kai kurių medžiagų atsparumas parodytas žemiau.Laidumas yra varžos grįžtamasis ryšys, yra „Siemens“ matavimo vienetas, - 1Sm = 1 / omas.
Jie turi gerą laidumą arba mažą varžą: sidabras 1,5 * 10 ^ (- 6), perskaitykite kaip (nuo pusantro iki dešimties iki galios atėmus šešis), varis 1,78 * 10 ^ (- 6), aliuminis 2,8 * 10 ^ (- 6). Didelio pasipriešinimo lydinių laidumas yra daug blogesnis: konstanta 0,5 * 10 ^ (- 4), nichromo 1,1 * 10 ^ (- 4). Šie lydiniai gali būti vadinami blogais laidininkais. Po visų šių sudėtingų skaičių pakeiskite omą / cm.
Be to, puslaidininkius galima atskirti kaip atskirą grupę: germanis 60 omų / cm, silicis 5000 omų / cm, selenas 100 000 omų / cm. Šios grupės varža yra didesnė nei blogų laidininkų, bet mažesnė nei blogų izoliatorių, jau nekalbant apie gerus. Tikriausiai su ta pačia sėkme puslaidininkiai galėtų būti vadinami pusiau izoliatoriais.
Po tokios trumpos pažinties su atomo struktūra ir savybėmis reikėtų pagalvoti, kaip atomai sąveikauja tarpusavyje, kaip atomai sąveikauja tarpusavyje, kaip iš jų sudaromos molekulės, iš kurių sudarytos įvairios medžiagos. Norėdami tai padaryti, vėl turėsite prisiminti elektronus, esančius išorinėje atomo orbitoje. Galų gale, būtent jie dalyvauja atomų sujungime į molekules ir nustato fizines ir chemines medžiagos savybes.
Kaip iš atomų gaminami atomai
Bet kuris atomas yra stabilioje būsenoje, jei jo išorinėje orbitoje yra 8 elektronai. Jis nesiekia paimti elektronų iš kaimyninių atomų, tačiau neatsisako savo. Norėdami tai patikrinti, pakanka periodinėje lentelėje pažvelgti į inertines dujas: neoną, argoną, kriptoną, ksenoną. Kiekvieno iš jų išorinėje orbitoje yra 8 elektronai, kurie paaiškina šių dujų nenorą užmegzti kokius nors ryšius (chemines reakcijas) su kitais atomais, sudaryti chemikalų molekules.
Situacija yra visai kitokia tiems atomams, kurių išorinėje orbitoje nėra 8 branginamų elektronų. Tokie atomai mieliau susijungia su kitais, kad papildytų savo išorinę orbitą iki 8 elektronų ir rastų ramią stabilią būseną.
Pavyzdžiui, gerai žinoma vandens molekulė H2O. Jį sudaro du vandenilio atomai ir vienas deguonies atomas, kaip parodyta paveikslėlyje. 1.
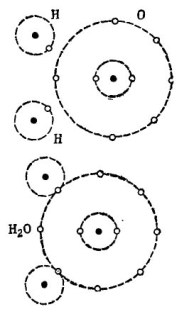
Piešimas 1. Kaip sukuriama vandens molekulė.
Viršutinėje paveikslo dalyje du vandenilio atomai ir vienas deguonies atomas parodyti atskirai. Deguonies išorinėje orbitoje yra 6 elektronai, netoliese yra du elektronai, esantys dviem vandenilio atomais. Deguonies, kol branginamojo skaičiaus 8 išorinėje orbitoje trūksta vos dviejų elektronų, kuriuos jis gaus pridėdamas sau du vandenilio atomus.
Kiekvieno vandenilio atomo išorinėje orbitoje trūksta 7 elektronų, kad būtų visiška laimė. Pirmasis vandenilio atomas savo išorinėje orbitoje gauna 6 elektronus iš deguonies, o kitas elektronas iš savo dvynio - antrąjį vandenilio atomą. Dabar jos išorinėje orbitoje kartu su elektronu yra 8 elektronai. Antrasis vandenilio atomas taip pat užbaigia savo išorinę orbitą iki branginamojo skaičiaus 8. Šis procesas parodytas apatinėje paveikslo dalyje. 1.
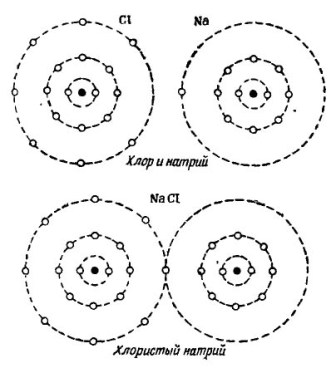
Nuotraukoje 2 Parodytas natrio ir chloro atomų sujungimo procesas. Rezultatas yra natrio chloridas, kuris parduodamas parduotuvėse, vadinamas druska.
Piešimas 2. Natrio ir chloro atomų sujungimo procesas
Čia taip pat kiekvienas iš dalyvių gauna trūkstamą elektronų skaičių iš kito: chloras pritvirtina vieną natrio elektroną prie savo septynių elektronų, o jis suteikia savo atomus natrio atomui. Abu atomai išorinėje orbitoje turi 8 elektronus, kur pasiekiamas visiškas susitarimas ir klestėjimas.
Atomų judėjimas
Atomai, kurių išorinėje orbitoje yra 6 arba 7 elektronai, linkę prie savęs prijungti 1 arba 2 elektronus. Jie sako apie tokius atomus, kad jie yra vienas ar dvivalenčiai. Bet jei atomo išorinėje orbitoje yra 1, 2 arba 3 elektronai, tada toks atomas linkęs juos atiduoti. Šiuo atveju atomas laikomas vienu, dviem arba trivalenčiu.
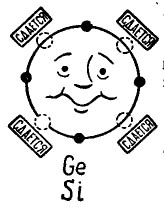
Jei išorinėje atomo orbitoje yra 4 elektronai, tada toks atomas teikia pirmenybę deriniui su tuo pačiu, kuriame taip pat yra 4 elektronai. Taip sujungiami tranzistorių gamyboje naudojami germanio ir silicio atomai. Šiuo atveju atomai vadinami tetravalentais. (Germanio arba silicio atomai gali būti derinami su kitais elementais, pavyzdžiui, su deguonimi ar vandeniliu, tačiau šie junginiai nėra įdomūs mūsų istorijos plane.)
Nuotraukoje 3 parodytas germanio arba silicio atomas, kurį norima sujungti su tuo pačiu atomu. Maži juodi apskritimai yra paties atomo elektronai, o šviesos apskritimai nurodo vietas, kur krinta keturių atomų - kaimynų - elektronai.
Piešimas 3. Germanio (silicio) atomas.
Puslaidininkių kristalinė struktūra
Periodinėje lentelėje esantys germanio ir silicio atomai yra toje pačioje grupėje kaip anglis (C deimanto cheminė formulė yra tiesiog dideli anglies kristalai, gaunami tam tikromis sąlygomis), todėl sujungti jie sudaro į deimantą panašią kristalinę struktūrą. Tokios struktūros formavimas parodytas supaprastintame, žinoma, pav 4.
Piešimas 4.
Kubo centre yra germanio atomas, o dar 4 atomai yra kampuose. Kubo centre pavaizduotas atomas savo valentiniais elektronais yra susietas su artimiausiais kaimynais. Savo ruožtu kampiniai atomai suteikia savo valentinius elektronus atomui, esančiam kubo centre, ir jo kaimynams - atomais, neparodytais paveiksle. Taigi išorines orbitas papildo iki aštuonių elektronų. Žinoma, krištolo gardelėje nėra kubo, jis tiesiog parodytas paveiksle, kad būtų aiškus abipusis, tūrinis atomų išdėstymas.
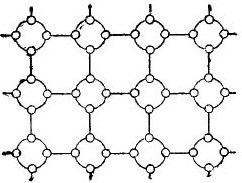
Bet norint kiek įmanoma supaprastinti pasakojimą apie puslaidininkius, krištolo gardelę galima pavaizduoti plokščio scheminio brėžinio pavidalu, nepaisant to, kad interatominės jungtys vis dėlto yra erdvėje. Tokia grandinė parodyta paveikslėlyje. 5.
Piešimas 5. Germanio krištolo grotelės yra plokščios formos.
Tokiame kristale visi elektronai yra tvirtai pritvirtinti prie atomų savo valentiniais ryšiais, todėl, matyt, laisvų elektronų čia tiesiog nėra. Pasirodo, priešais mus yra paveiksle esantis izoliatorius, nes jame nėra laisvų elektronų. Bet iš tikrųjų taip nėra.
Vidinis laidumas
Faktas yra tas, kad veikiant temperatūrai, kai kurie elektronai vis tiek sugeba atsiriboti nuo savo atomų ir kurį laiką išsilaisvinti iš jungties su branduoliu. Todėl germanio kristale yra nedidelis laisvųjų elektronų kiekis, dėl kurio įmanoma atlikti elektros srovę. Kiek laisvų elektronų yra germanio kristale normaliomis sąlygomis?
Viename 10 ^ 10 (dešimt milijardų) atomų yra ne daugiau kaip du tokie laisvi elektronai, taigi germanis yra prastas laidininkas arba, kaip įprasta sakyti, puslaidininkis. Reikia pažymėti, kad tik viename grame germanio yra 10 ^ 22 (dešimt tūkstančių milijardų milijardų) atomų, o tai leidžia „gauti“ apie du tūkstančius milijardų laisvų elektronų. Atrodo, kad to pakanka praleisti didelę elektros srovę. Norėdami išspręsti šį klausimą, pakanka prisiminti, kokia 1 A srovė.
1 A srovė reiškia, kad per laidininką per vieną sekundę praeina 1 kulono arba 6 * 10 ^ 18 (šešių milijardų milijardų) elektronų per sekundę elektros krūvis. Atsižvelgiant į tai, mažai tikėtina, kad du tūkstančiai milijardų laisvų elektronų, net išsibarstę po didžiulį kristalą, užtikrintų aukštų srovių pralaidumą. Nors dėl šiluminio judesio Vokietijoje yra mažas laidumas. Tai yra vadinamasis vidinis laidumas.
Elektroninis ir skylių laidumas
Kylant temperatūrai, papildoma energija perduodama elektronams, jų šiluminė virpesiai tampa energingesni, todėl kai kuriems elektronams pavyksta atitrūkti nuo savo atomų.Šie elektronai tampa laisvi ir, nesant išorinio elektrinio lauko, daro atsitiktinius judesius ir juda laisvoje erdvėje.
Atomai, praradę elektronus, negali atlikti atsitiktinių judesių, o tik šiek tiek svyruoti, palyginti su jų normalia padėtimi kristalų gardelėje. Tokie atomai, praradę elektronus, vadinami teigiamaisiais jonais. Mes galime manyti, kad vietoje elektronų, suplėšytų iš jų atomų, gaunami laisvi tarpai, kurie paprastai vadinami skylėmis.
Apskritai elektronų ir skylių skaičius yra tas pats, todėl skylė gali užfiksuoti šalia esantį elektroną. Dėl to iš teigiamo jono atomas vėl tampa neutralus. Elektronų sujungimo su skylėmis procesas vadinamas rekombinacija.
Tuo pačiu dažniu elektronai yra atskirti nuo atomų, todėl vidutiniškai tam tikro puslaidininkio elektronų ir skylių skaičius yra lygus, yra pastovus ir priklauso nuo išorinių sąlygų, ypač nuo temperatūros.
Jei puslaidininkio kristalui taikoma įtampa, tada elektronų judėjimas bus nurodytas, per kristalą tekės srovė dėl jo elektronų ir skylių laidumo. Šis laidumas vadinamas vidiniu, jis jau buvo paminėtas šiek tiek didesnis.
Bet gryni puslaidininkiai, turintys elektroninį laidumą ir skylių laidumą, nėra tinkami diodams, tranzistoriams ir kitoms detalėms gaminti, nes šių prietaisų pagrindas yra p-n (perskaitykite „pe-en“) jungtis.
Norint gauti tokį perėjimą, reikia dviejų tipų puslaidininkių, dviejų tipų laidumo (p - teigiamas - teigiamas, skylė) ir (n - neigiamas - neigiamas, elektroninis). Šios rūšies puslaidininkiai gaunami dopingo būdu, į grynus germanio arba silicio kristalus pridedant priemaišų.
Nors priemaišų kiekis yra labai mažas, jų buvimas didele dalimi keičia puslaidininkio savybes, leidžia gauti skirtingo laidumo puslaidininkius. Tai bus aptarta kitoje straipsnio dalyje.
Borisas Aladyshkinas, https://ltv.electricianexp.com
Taip pat žiūrėkite tinklalapyje bgv.electricianexp.com
: