Kategorijos: Teminiai straipsniai » Pradedantieji elektrikai
Peržiūrų skaičius: 36288
Straipsnio komentarai: 1
Cheminių srovių šaltiniai: pagrindinės charakteristikos
 Daugiau nei du šimtmečius žmonija naudoja cheminių reakcijų energiją tarp įvairių medžiagų, kad būtų sukurta nuolatinė srovė.
Daugiau nei du šimtmečius žmonija naudoja cheminių reakcijų energiją tarp įvairių medžiagų, kad būtų sukurta nuolatinė srovė.
Darbo principas
Redox reakcija, vykstanti tarp medžiagų, turinčių oksidatoriaus ir reduktoriaus savybes, lydi elektronų, kurių judėjimas sukuria elektros srovę, išsiskyrimą. Tačiau norint panaudoti savo energiją, būtina sudaryti sąlygas elektronams praeiti pro išorinę grandinę, kitaip jis išsiskiria šiluma iš paprasto oksiduojančiojo ir redukuojančiojo mišinio mišinio.
Todėl visi cheminės srovės šaltiniai turi du elektrodus:
-
anodas, ant kurio vyksta oksidacija;
-
katodas, atliekantis medžiagos redukciją.
Elektrodai per atstumą dedami į indą su elektrolitu - medžiaga, kuri veda elektros srovę dėl terpės atsiribojimo į jonus procesų.
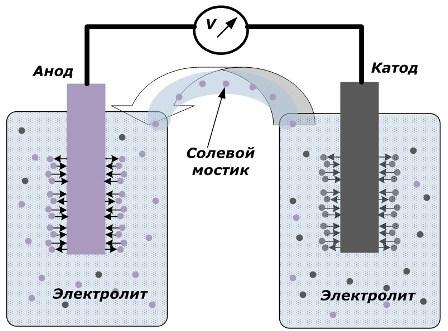
Cheminės energijos pavertimo elektros energija principas
Paveikslėlyje parodyta, kad elektrodai yra dedami į atskirus indus, sujungtus druskos tiltu, per kurį sukuriamas jonų judėjimas išilgai vidinės grandinės. Kai išorinės ir vidinės grandinės yra atviros, elektroduose vyksta du procesai: jonų perėjimas iš elektrodo metalo į elektrolitą ir jonų perėjimas iš elektrolito į elektrodų kristalinę gardelę.
Šių procesų srautai yra vienodi ir kiekviename elektrode kaupiasi priešingų ženklų įtampos potencialai. Jei jie bus sujungti per druskos tiltą ir bus veikiama apkrova, įvyks elektros grandinė. Vidinė srovė sukuriama jonams judant tarp elektrodų per elektrolitą ir druskos tiltelį. Elektronų judėjimas išilgai išorinės grandinės kryptimi nuo anodo iki katodo.
Beveik visas redox reakcijas lydi elektros energijos gamyba. Bet jo vertė priklauso nuo daugelio veiksnių, įskaitant naudojamų chemikalų tūrį ir masę, medžiagas, naudojamas elektrodams gaminti, pavyzdžiui, elektrolitą, jonų koncentraciją, dizainą.
Šiuolaikiniuose cheminių srovių šaltiniuose plačiausiai naudojami:
-
anodo medžiagai (reduktoriui) - cinkas (Zn), švinas (Pb), kadmis (Cd) ir kai kurie kiti metalai;
-
už katodo medžiagą (oksidatorių) - švino oksidas PbO2, mangano oksidas MnO2, nikelio hidroksidas NiOOH ir kiti;
-
elektrolitai, sudaryti iš rūgščių, šarmų ar druskų tirpalų.
Klasifikavimo metodai
Vieną cheminių energijos šaltinių dalį galima naudoti pakartotinai, o kitą - ne. Šis principas yra jų klasifikavimo pagrindas.
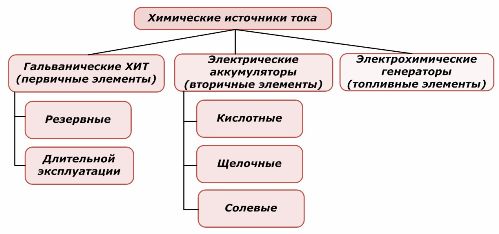
Cheminių elementų klasifikacija
Elektromotorinė jėga galvaniniai elementai, priklausomai nuo konstrukcijos, siekia 1,2 ÷ 1,5 volto. Norėdami gauti dideles vertes, jie sujungiami į baterijas, sujungiant nuosekliai. Kai baterijos prijungiamos lygiagrečiai, padidėja srovė ir galia.
Visuotinai pripažįstama, kad pirminiai cheminiai srovės šaltiniai nepalaiko įkrovimo, nors tiksliau šią poziciją galima suformuluoti skirtingai: jos įgyvendinimas nėra ekonomiškai pagrįstas.
Nereikalingi pirminės cheminės srovės šaltiniai yra laikomi tokioje būsenoje, kai elektrolitas yra izoliuotas nuo elektrodų. Tai pašalina redoksinės reakcijos pasireiškimą ir užtikrina pasirengimą paleidimui. Jie nėra pakartotinai naudojami. Cheminių atsarginių energijos šaltinių tinkamumo laikas yra ribotas iki 10–15 metų.
Baterijos sėkmingai įkraunamos naudojant išorinę elektros energiją. Dėl šios savybės jie vadinami antriniais srovės šaltiniais. Jie gali atlaikyti šimtus ir tūkstančius įkrovimo-iškrovimo ciklų.Akumuliatoriaus EML gali būti 1,0 ÷ 1,5 volto diapazonas. Jie taip pat sujungiami į baterijas.
Elektrocheminiai generatoriai veikia galvaninių elementų principu, tačiau jie neša medžiagas iš išorės, kad vykdytų elektrocheminę reakciją, o visi išsiskyrę produktai pašalinami iš elektrolito. Tai leidžia organizuoti nenutrūkstamą procesą.
Pagrindinės cheminių energijos šaltinių eksploatacinės savybės
1. Įtampa per atvirus gnybtus
Atsižvelgiant į dizainą, vienas šaltinis gali sukurti tik tam tikrą potencialo skirtumą. Elektriniams prietaisams naudoti jie sujungiami į baterijas.
2. Specifinis pajėgumas
Tam tikrą laiką (valandomis) vienas cheminis srovės šaltinis gali generuoti ribotą kiekį srovės (amperais), kuri priskiriama svorio arba tūrio vienetui.
3. Galios tankis
Tai apibūdina cheminio srovės šaltinio svorio arba tūrio vieneto sugebėjimą generuoti energiją, kurią sukuria įtampos produktas pagal srovės stiprį.
4. Operacijos trukmė
Šis parametras taip pat vadinamas galiojimo data.
5. Savaiminio išlydžio srovių vertė
Šie šalutiniai elektrocheminių reakcijų procesai lemia aktyviosios elementų masės sunaudojimą, sukelia koroziją ir sumažina savitąją talpą.
6. Produkto kaina
Priklauso nuo dizaino, naudojamų medžiagų ir daugelio kitų veiksnių.
Geriausi cheminių srovių šaltiniai yra tie, kurių pirmosios keturių parametrų vertės yra aukštos, o savaiminis išsiskyrimas ir sąnaudos yra žemos.
Baterijos įkrovimo principai
Tarp antrinių dabartinių cheminių šaltinių jie populiarėja. ličio jonų modeliai, kurie tapo plačiai naudojami elektroniniams prietaisams maitinti. Jie naudoja LiMO2 (M Co, Ni, Mn) kaip teigiamo elektrodo medžiagą, o grafitą - kaip neigiamą elektrodą.
Įkraunami ličio jonai iš panaudotos išorinės energijos išsiskiria iš katodo metalo, praeina per elektrolitą ir prasiskverbia į erdvę tarp grafito sluoksnių, ten kaupdamiesi.
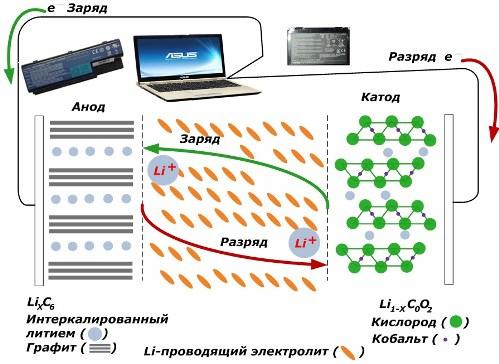
Kai energija įkroviklis nėra, o apkrova sujungta su elektrodais, tada ličio jonai elektrolite juda priešinga kryptimi.
Jei įkrovimas ir iškrovimas neatliekami, akumuliatoriuje energija nėra sunaudojama, o kaupiama. Tačiau jo kiekį riboja naudojamų medžiagų savybės. Pavyzdžiui, ličio jonų baterijose savitoji elektrinė talpa yra 130 ÷ 150 mAh / g. Tai riboja anodo medžiagos savybės. Grafito talpa yra maždaug du kartus didesnė.
Dabar mokslininkai ieško būdų, kaip padidinti akumuliatoriaus talpą, tyrinėja galimybę panaudoti cheminę reakciją tarp ličio ir deguonies ore. Tam tikslui kuriami orai, neišmetamas katodas, naudojami atskirose baterijose. Šis metodas gali padidinti energijos tankį iki 10 kartų.
Cheminių srovės šaltinių veikimui reikalingos žinios elektrotechnikos pagrindai, elektrochemija, medžiagų mokslas ir kietojo kūno fizika.
Taip pat žiūrėkite tinklalapyje bgv.electricianexp.com
:
